PREGUNTAS FRECUENTES
-
Para acceder a la Cita Previa del Centro de Salud Online puede hacerlo mediante las siguientes opciones:
- NIF y Fecha de Nacimiento: Introduciendo su NIF o NIE y su fecha de nacimiento.
- CIP: Introduciendo su código de identificación personal en el Sistema de Información de Tarjeta Sanitaria.
- DNI electrónico: Si dispone de certificado digital.
* Por motivos de seguridad, sólo con el certificado digital tendrá acceso a las siguientes opciones:
- Mi Historial Clínico
- Mis Tratamientos
- Mis Datos de Salud
-
Para consultar una cita médica obtenida previamente a través del Centro de Salud Online deberá acceder a la opción "Citas planificadas" que encontraremos dentro del apartado "Cita Previa".
Una vez identificados en el Centro de Salud Online obtendrá, como resultado, la visualización del listado de citas que tiene pendientes y que podrá también Imprimir o Anular.
-
Para anular una cita médica obtenida previamente a través del Centro de Salud Online deberá acceder a la opción "Anular una cita" que encontraremos dentro del apartado "Cita Previa". El resultado será la visualización del listado de citas que tiene pendientes y que podrá también Anular.
Para anular una cita tan sólo tendrá que seleccionar la cita que desea anular y pulsar sobre el botón que le indica la acción que desea realizar (ANULAR CITA).
-
Sí, de la misma forma que en la pregunta anterior.
-
No se puede modificar una cita ya confirmada por el Centro de Salud Online. Debe proceder a anularla y realizar una nueva solicitud de cita.
-
Sí, en el Centro de Salud Online veo todas las citas médicas (Médico de Cabecera y Pediatra) que tengo pendientes en mi Centro de Salud.
-
Los motivos que pueden motivar dicho fallo son:
- Porque el Centro de Salud o Consultorio, no tenga aún disponible la cita previa a través de Internet.
- Porque el Médico de Cabecera o Pediatra aún no tenga disponible la Agenda, por diversos motivos: Vacaciones, Baja del Profesional, pertenece a un Centro que no tiene la cita previa habilitada.
- Por problemas técnicos puntuales.
Si estos problemas persistieran, puede comunicarlo a través de la cuenta de correo electrónico: inf.saludextremadura@salud-juntaex.es
-
En caso de que los datos de su médico no aparezcan correctamente debe ponerse en contacto con su Centro de Salud al objeto de actualizar los datos.
-
En este momento, el servicio de cita médica por internet sólo le permite solicitar hora con su Médico de Atención Primaria o Pediatra, seleccionando entre 2 tipos de consultas diferentes:
*Administrativa: para resolver alguna cuestión administrativa como pueden ser las recetas para tratamientos crónicos o prolongados, partes de incapacidad temporal....
*Demanda: para resolver algún problema o necesidad de salud.
En cualquier otra circunstancia, debe ponerse en contacto con su Centro de Salud.
-
Según los datos facilitados anualmente por la Administración Tributaria, las casillas de la declaración de I.R.P.F. a tener en cuenta para la determinación del TSI son: Base liquidable general más base liquidable del ahorro.
*Resolución de 15 de diciembre de 2014 (B.O.E. 23 diciembre 2014)
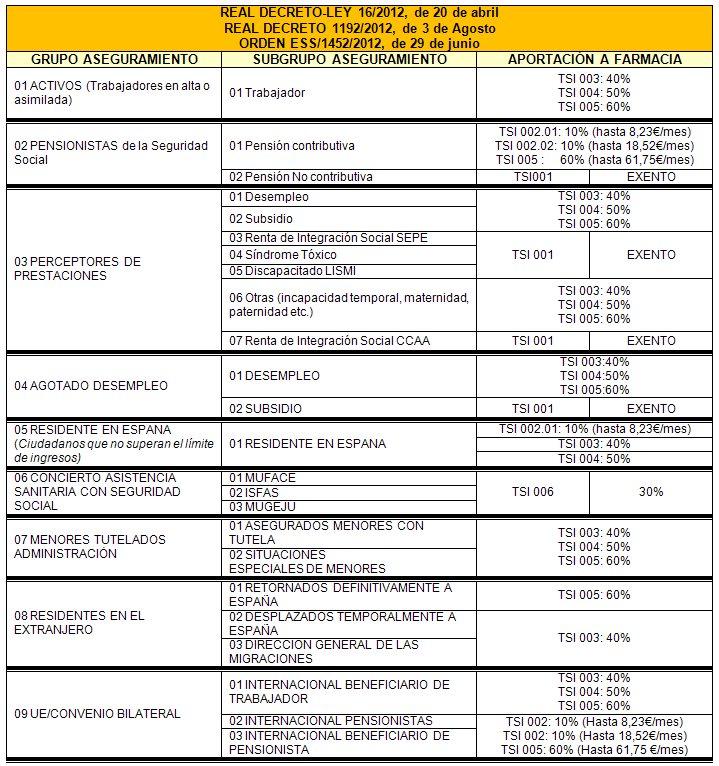
Para descargar la tabla en formato PDF: GRUPOS Y SUBGRUPOS DE ASEGURAMIENTO Y APORTACION FARMACEUTICA
-
Los límites de aportación a farmacia para los ciudadanos pensionistas con pensiones contributivas de la Seguridad Social y activos son las que se detallan a continuación:

-
Descargar modelo de solicitud de COMUNICACIÓN DE DISCREPANCIAS DE DATOS.
-
Estas directrices se han elaborado en el grupo de productos sanitarios del Comité Técnico de Inspección, constituido por representantes de comunidades autónomas y del Departamento de Productos Sanitarios, de la Agencia Española de Medicamento y Productos Sanitarios (AEMPS) y pretende facilitar la aplicación de la legislación de productos sanitarios a medida.
Para facilitar su consulta se han agrupado las preguntas-respuestas en cuatro grupos temáticos: GENERALES (preguntas 1-7), DENTALES (preguntas 8-18), ORTOPROTÉSICOS (preguntas 19-22) y ÓPTICOS (preguntas 23-26).
-
El trámite del registro de responsables es posterior al de la licencia. La citada comunicación hay que presentarla cuando comience la comercialización de los productos.
-
Titulación que acredite una cualificación adecuada en función de los productos que tenga a su cargo.
Art. 3, R.D. 437/2002, de 10 de mayo, por el que se establecen los criterios para la concesión de licencias sanitarias a medida.
-
Las empresas subcontratadas deben cumplir los mismos requisitos que si están ubicadas en España. Disponibilidad de instalaciones, procedimientos, equipamiento y personal adecuado según las actividades y productos de que se trate.
Art. 10.1.b del R.D. 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios.
-
Las empresas subcontratadas deben cumplir los mismos requisitos que si están ubicadas en España. Disponibilidad de instalaciones, procedimientos, equipamiento y personal adecuado según las actividades y productos de que se trate.
Art. 10.1.b del R.D. 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios.
-
No, la toma de medidas se puede realizar en otro centro o establecimiento sanitario por el profesional técnico cualificado.
-
No, son los productos sanitarios a medida de clase IIa, IIb ó III los que deben ir acompañados de la declaración de conformidad. No obstante, el paciente, debe ser informado de que tiene a su disposición esta declaración, que a su requerimiento le deben entregar.
Art. 16.1.b) del RD 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios.
-
Sí, la colocación o puesta en servicio de productos sanitarios a medida por un facultativo, en el ejercicio de sus atribuciones profesionales, no tendrá la consideración de dispensación, comercialización, venta, distribución, suministro o puesta en el mercado de los mismos, a los efectos de los artículos 3.1 y 101. En todo caso el facultativo deberá separar sus honorarios de los costes de fabricación.
Disposición adicional décimo tercera. Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios.
-
Cualquier persona física o jurídica excepto los profesionales sanitarios incluidos en Art. 3 Ley 29/2006. El ejercicio clínico de la medicina, odontología, veterinaria y otras profesiones sanitarias con facultad para prescribir o indicar la dispensación de los medicamentos, serán incompatibles con cualquier clase de intereses económicos directos derivados de la fabricación, elaboración, distribución y comercialización de los medicamentos y productos sanitarios. Por lo tanto, estos profesionales no podrían ser titulares de un laboratorio de prótesis dentales.
Art. 3 Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios.
-
No, en ningún caso.
R.D. 1594/1994, de 15 de julio, por el que se desarrolla lo previsto en la Ley 10/1986, que regula la profesión de Odontólogo, Protésico e Higienista dental y R.D. 541/1995, de 7 de abril, por el que se establece el título de técnico superior en prótesis dentales y las correspondientes enseñanzas mínimas.
-
Sí, la importación de prótesis dentales a medida terminadas requiere licencia sanitaria previa de funcionamiento de la instalación como importador, otorgada por AEMPS.
El despacho de estos productos en la aduana está sometido a la inspección de los servicios de inspección farmacéutica. Es necesaria la aportación de la copia de los siguientes documentos:
-Licencia previa de funcionamiento de la instalación como importador.
-Declaración de conformidad donde debe figurar el fabricante del país tercero.
Estos importadores deberán contar con un responsable técnico con titulación universitaria sanitaria o relacionada con la tecnología de la fabricación de los productos.
Si se introducen en España prótesis dentales terminadas cuya fabricación se ha subcontratado fuera de España (país no perteneciente a la UE) y en las que aparecerá el fabricante español como fabricante del producto, no se requerirá licencia de importador, sino la presentación en la aduana de la Licencia de Fabricante, con el objeto de que comprueben que los productos y la empresa subcontratada figuran en el documento de la licencia.
Fabricación e importación de prótesis dentales, materias primas y productos intermedios. AEMPS versión 21/03/2010.
-
No se requiere licencia de importación, porque los productos forman parte de un proceso de fabricación autorizado.
La actividad se realiza por:
- Fabricante de prótesis dentales a medida que ha subcontratado la fabricación de producto intermedio a un fabricante de un tercer país.
- Agente económico, no fabricante, que introduzca productos intermedios para fabricantes a medida.
En el documento de licencia de fabricación a medida aparecerán los datos de la empresa subcontratada en el tercer país, a efectos de comprobar en aduana, en caso necesario origen y destino.
Fabricación e importación de prótesis dentales, materias primas y productos intermedios. AEMPS versión 21/03/2010.
-
El responsable técnico puede trabajar en más de un laboratorio siempre que esté presente en el horario de actividad del mismo y la legislación autonómica no lo prohíba.
-
Sí, un laboratorio de prótesis dental puede vender directamente la prótesis al paciente, pero este debe acudir al odontólogo para su colocación y adaptación final. El protésico dental en su laboratorio no puede, bajo ninguna circunstancia, colocar la prótesis al paciente ya que se trataría de intrusismo profesional.
-
El protésico dental no puede realizar una reparación de una prótesis dental directamente, ya que una vez reparada, se debe probar si se adapta correctamente, cosa que solo puede hacer el odontólogo en su consulta dental.
-
Sí, la colocación o puesta en servicio de productos sanitarios a medida por un facultativo, en el ejercicio de sus atribuciones profesionales, no tendrá la consideración de dispensación, comercialización, venta, distribución, suministro o puesta en el mercado de los mismos, a los efectos de los artículos 3.1 y 101. En todo caso, el facultativo deberá separar sus honorarios de los costes de fabricación.
Disposición adicional 13 de la Ley 29/2006, de 26 de julio, de Garantías y Uso Racional de los Medicamentos y Productos Sanitarios.
-
No, el ejercicio clínico de la medicina, odontología, veterinaria y otras profesiones sanitarias con facultad para prescribir o indicar la dispensación de los medicamentos, serán incompatibles con cualquier clase de intereses económicos directos derivados de la fabricación, elaboración, distribución y comercialización de los medicamentos y productos sanitarios.
Artículo 3.1 de la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios, modificado por la Ley 28/2009, de 30 de diciembre.
-
No es obligatorio que la empresa subcontratada disponga de LFAM. El laboratorio de prótesis dental se responsabiliza del producto con etiquetado a su nombre y emite por tanto, declaración de conformidad e instrucciones de uso. En LFAM del laboratorio de prótesis dental deben constar los fabricantes subcontratados y los productos, independientemente de que los subcontratados tengan o no licencia de fabricantes.
Art. 9.2 del R.D. 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios.
-
Sí, las empresas subcontratadas por los laboratorios de prótesis dentales deben tener un protésico dental responsable de la fabricación.
Art. 5, 6 y 7 R.D. 1594/1994, de 15 julio, por el que se desarrolla lo previsto en la Ley 10/1986, que regula la profesión de Odontólogo, Protésico e Higienista dental y R.D. 541/1994, de 7 de abril, por el que se establece el título de técnico superior en prótesis dentales y las correspondientes enseñanzas mínimas.
-
No, la empresa que se responsabiliza de la relación con el paciente es la que debe tener las instalaciones adaptadas y equipadas para atenderle de manera adecuada y es la empresa que tiene LFAM.
-
El responsable técnico puede trabajar en más de un fabricante siempre que esté presente en el horario de actividad del mismo y la legislación autonómica no lo prohíba.
-
Tras la modificación de los artículos 3 y 77.1 de la Ley 29/2006 de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios, la práctica clínica de la podología será incompatible con cualquier clase de intereses directos derivados de la fabricación, elaboración, distribución y comercialización de los medicamentos y productos sanitarios.
La Ley 44/2003, de 21 de noviembre, de Ordenación de las profesiones sanitarias, en su artículo 7.2 d) determina que los podólogos están facultados para el diagnóstico y tratamiento de las afecciones y deformidades de los pies, mediante las técnicas terapéuticas propias de su disciplina. La especial referencia de la Ley a las deformidades de los pies y la aplicación de las técnicas de la especialidad como terapéutica definiría la peculiaridad de las competencias del podólogo, y a la ortopodología como coadyuvante a otros tratamientos o como tratamiento único.
En consecuencia no existiría por parte del podólogo intereses económicos en la fabricación y comercialización de los productos siempre que los fabricase o prescribiese como tratamientos para sus pacientes sin fabricar y distribuir a terceros.
-
Los establecimientos de ortopedia que, por definición, realizan actividades de adaptación individualizada pueden adaptar tanto productos sanitarios fabricados en serie como, si la legislación autonómica no lo prohíbe, productos fabricados a medida. Lo habitual, sin embargo, es que sea el fabricante a medida del producto sanitario quien realice también la adaptación final del producto en el paciente.
-
Sí, el fabricante debe contar con la preceptiva LFAM. Se trata de un producto sanitario para compensar una lesión o una deficiencia y fabricado específicamente según la prescripción de un facultativo especialista.
Art. 9 de RD 1591/2011, de 16 de octubre, por el que se regulan los productos sanitarios
-
Sí, necesitan prescripción porque están considerados productos sanitarios a medida.
Art. 2.1 d) RD 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios.
-
No, la óptica realiza la adaptación del producto y es el fabricante de las lentes quien debe obtener la preceptiva licencia de fabricante a medida.
-
Las lentes de contacto tengan o no finalidad correctiva, se considera que requieren una adaptación individualizada por un profesional cualificado, el establecimiento de venta de las mismas deberá contar con la presencia de dicho profesional y el equipamiento necesario para realizar la adaptación. Las condiciones señaladas corresponden a los establecimientos sanitarios de ópticas.
Artículos 3.1.c) y 27.3 del RD 1541/2009 de 16 de octubre, por el que se regulan los productos sanitarios y criterio interpretativo AEMPS.
-
UE: Unión Europea
LFAM: Licencia de fabricación a medida
RD: Real Decreto
-
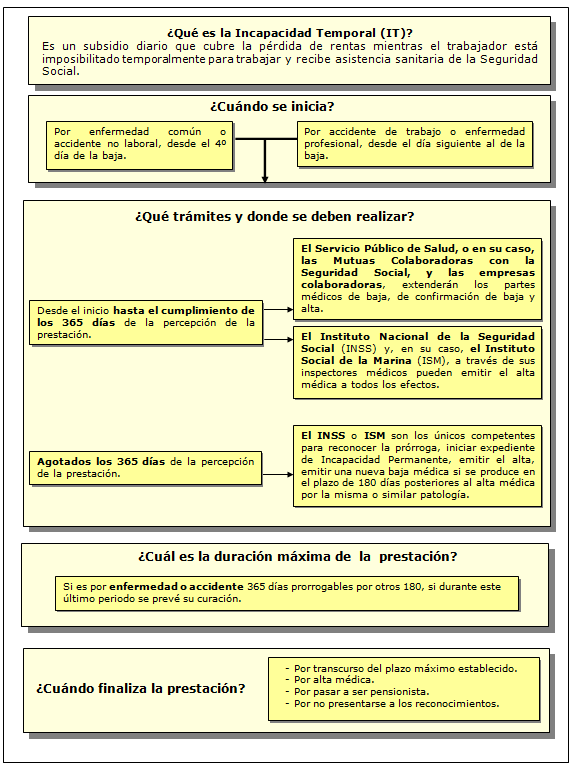
Situación en la que se encuentran los trabajadores, impedidos temporalmente para trabajar debido a enfermedad común o profesional y accidente, sea o no de trabajo, mientras reciban asistencia sanitaria de la Seguridad Social, así como los períodos de observación por enfermedad profesional en los que se prescriba la baja en el trabajo durante los mismos.
Más información:
https://www.seg-social.es/wps/portal/wss/internet/Trabajadores/PrestacionesPensionesTrabajadores
-
Las Bajas laborales deben ser emitidas por su médico de familia, pues es quien tiene el conocimiento del paciente a través de la historia clínica y de su entorno social y familiar, permitiéndole una mejor valoración del problema de salud que condiciona la capacidad laboral.
-
La incapacidad temporal es una de las prestaciones sanitarias y sociales más importantes de nuestro Sistema Nacional de Salud, ya que a través de la utilización y prescripción de ésta permite a un paciente que trabaja utilizar el reposo sin pérdida económica para mejorar el problema de salud que le afecta.
-
1. Se entiende por accidente de trabajo toda lesión corporal que el trabajador sufra con ocasión o por consecuencia del trabajo que ejecute por cuenta ajena.
2. Tendrán la consideración de accidentes de trabajo:
- Los que sufra el trabajador al ir o al volver del lugar de trabajo.
- Los que sufra el trabajador con ocasión o como consecuencia del desempeño de cargos electivos de carácter sindical, así como los ocurridos al ir o al volver del lugar en que se ejerciten las funciones propias de dichos cargos.
- Los ocurridos con ocasión o por consecuencia de las tareas que, aún siendo distintas a las de su categoría profesional, ejecute el trabajador en cumplimiento de las órdenes del empresario o espontáneamente en interés del buen funcionamiento de la empresa.
- Los acaecidos en actos de salvamento y en otros de naturaleza análoga, cuando unos y otros tengan conexión con el trabajo.
- Las enfermedades, no incluidas en el artículo siguiente, que contraiga el trabajador con motivo de la realización de su trabajo, siempre que se pruebe que la enfermedad tuvo por causa exclusiva la ejecución del mismo.
- Las enfermedades o defectos, padecidos con anterioridad por el trabajador, que se agraven como consecuencia de la lesión constitutiva del accidente.
- Las consecuencias del accidente que resulten modificadas en su naturaleza, duración, gravedad o terminación, por enfermedades intercurrentes, que constituyan complicaciones derivadas del proceso patológico determinado por el accidente mismo o tengan su origen en afecciones adquiridas en el nuevo medio en que se haya situado el paciente para su curación.
-
Se entenderá por enfermedad profesional la contraída a consecuencia del trabajo ejecutado por cuenta ajena en las actividades que se especifiquen en el cuadro que se apruebe por las disposiciones de aplicación y desarrollo de esta Ley, y que esté provocada por la acción de los elementos o sustancias que en dicho cuadro se indiquen para cada enfermedad profesional.
En tales disposiciones se establecerá el procedimiento que haya de observarse para la inclusión en dicho cuadro de nuevas enfermedades profesionales que se estime deban ser incorporadas al mismo. Dicho procedimiento comprenderá, en todo caso, como trámite preceptivo, el informe del Ministerio de Sanidad y Política Social.
-
Se considerará que constituyen enfermedad común las alteraciones de la salud que no tengan la condición de accidentes de trabajo ni de enfermedades profesionales, conforme a lo dispuesto, respectivamente, en los apartados 2.e), f) y g) del artículo 156 y en el artículo 157.
-
Se considerará accidente no laboral el que, conforme a lo establecido en el artículo 156, no tenga el carácter de accidente de trabajo.
-
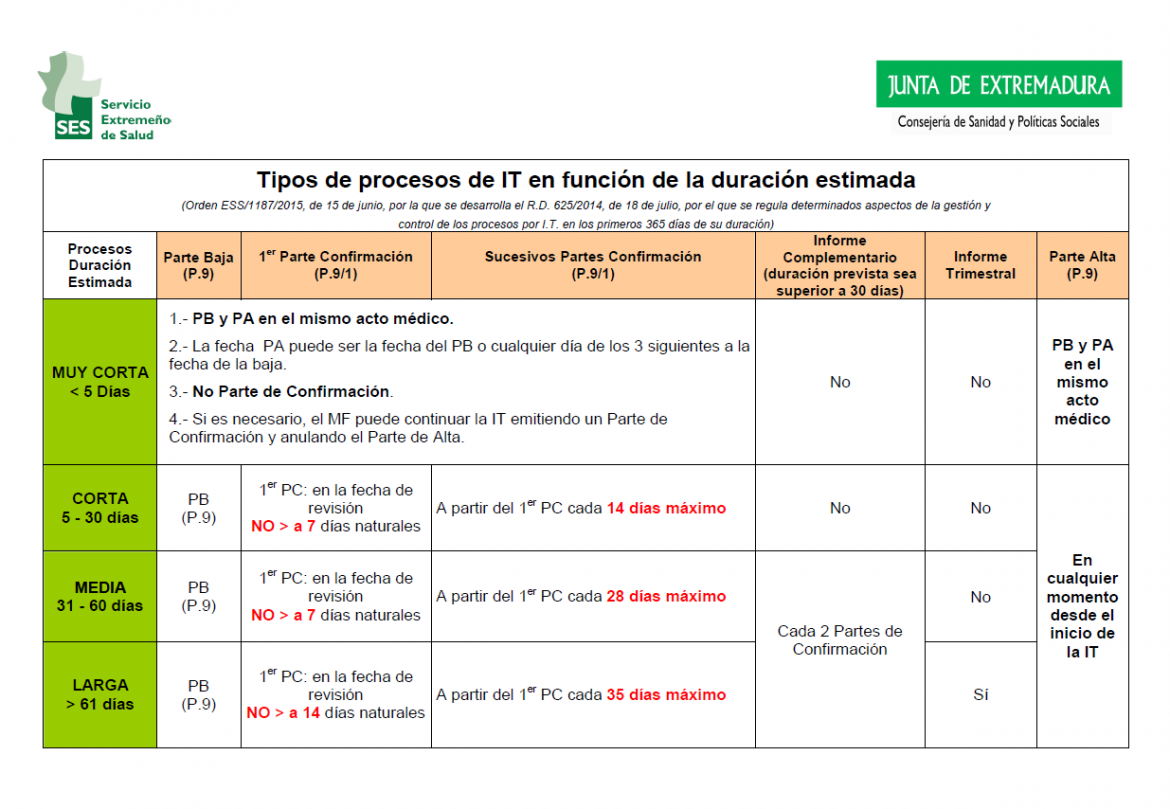
La normativa establece cuatro grupos de procesos:
- Procesos de duración muy corta: En los procesos de duración estimada inferior a 5 días, se podrá emitir el parte de baja y el de alta en el mismo acto médico.
- Procesos de duración corta: En los procesos de duración estimada entre 5 y 30 días, se revisará el estado del trabajador como máximo a los 7 días. En la fecha de la revisión se extenderá parte de alta o parte de confirmación. Después de este primer parte de confirmación, los sucesivos, cuando sean necesarios, no podrán emitirse con una diferencia de más de 14 días.
- Procesos de duración media: En los procesos de duración estimada entre 31 y 60 días, se revisará el estado del trabajador como máximo a los 7 días. En la fecha de la revisión se extenderá parte de alta o parte de confirmación. Después de este primer parte de confirmación, los sucesivos, cuando sean necesarios, no podrán emitirse con una diferencia de más de 28 días.
- Procesos de duración larga: En los procesos de duración estimada de más de 61 días, se revisará el estado del trabajador como máximo a los 14 días. En la fecha de la revisión se extenderá parte de alta o parte de confirmación. Después de este primer parte de confirmación, los sucesivos, cuando sean necesarios, no podrán emitirse con una diferencia de más de 35 días.
-
La Orden ESS/1187/2015, que desarrolla el Real Decreto 625/2014, establece dos modelos de partes médicos de incapacidad temporal:
- Modelo Parte médico de baja / alta de incapacidad temporal.
- Modelo Parte médico de confirmación de incapacidad temporal.
-
La IT se puede extinguir por:
- el transcurso del plazo máximo establecido,
- alta médica por curación o mejoría que permita al trabajador realizar su trabajo habitual,
- alta médica con o sin declaración de incapacidad permanente,
- el reconocimiento de la pensión de jubilación,
- la incomparecencia injustificada a cualquiera de las convocatorias para los exámenes y reconocimientos establecidos por los médicos adscritos al Instituto Nacional de la Seguridad Social o a la mutua colaboradora con la Seguridad Social,
- fallecimiento.
-
Ante cualquier traslado a otra Comunidad Autónoma, estando en baja laboral, SIEMPRE debemos contactar con nuestro médico o con la inspección médica que nos corresponda, que nos informarán adecuadamente que documentación deberemos entregar en la comunidad de destino (PARTE DE CONFIRMACION POR TRASLADO en el que se indique el último parte de confirmación emitido en Extremadura).
-
Enfermedad o accidente: 365 días prorrogables por otros 180, sí durante este transcurso se prevé curación.
Períodos de observación de la enfermedad profesional: 6 meses prorrogables por otros 6.
Agotado ese plazo, el trabajador será examinado por el INSS, que podrá:
- Prorrogar la baja 6 meses más, sólo cuando se presuma que en estos 6 meses el trabajador puede ser dado de alta médica por curación.
- Iniciar un expediente de incapacidad permanente.
- Emitir el alta médica.
-
Las nuevas bajas laborales después de un alta laboral emitida por los inspectores médicos del INSS, deben ser autorizadas por el INSS.
Según lo dispuesto en el artículo 170 del Real Decreto Legislativo 8/2015, de 30 de octubre, por el que se aprueba el texto refundido de la Ley General de la Seguridad Social, los inspectores médicos del INSS pueden emitir altas médicas.
Cuando el alta haya sido expedida por el INSS, este será el único competente, a través de sus propios inspectores médicos, para emitir una nueva baja médica producida por la misma o similar patología en los ciento ochenta días siguientes a la citada alta médica.
-
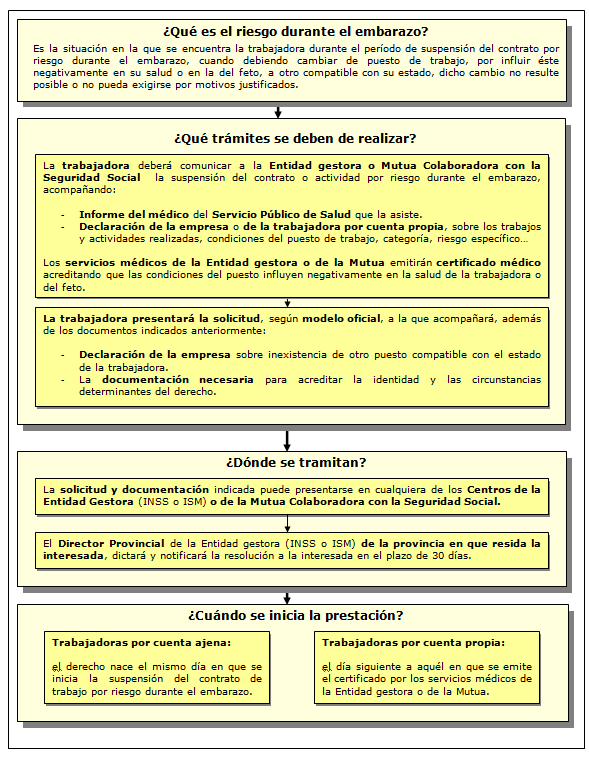
Es la situación en la que se encuentra la trabajadora durante el período de suspensión del contrato por riesgo durante el embarazo, cuando debiendo cambiar de puesto de trabajo, por influir éste negativamente en su salud o en la del feto, a otro compatible con su estado, dicho cambio no resulte posible o no pueda exigirse por motivos justificados.
¿Dónde tramitarlo? La solicitud y documentación necesaria deberá dirigirse a cualquiera de los Centros de Atención e Información de la Seguridad Social de la Entidad gestora o, en su caso, a la Mutua colaboradora con la Seguridad Social.
¿Cuantía? Subsidio equivalente al 100% de la base reguladora correspondiente, que será la establecida para la prestación de IT derivada de contingencias profesionales.
El modelo de solicitud se puede descargar de la página de la Seguridad Social.
Más información: https://www.seg-social.es/wps/portal/wss/internet/InformacionUtil/44539/44765
-
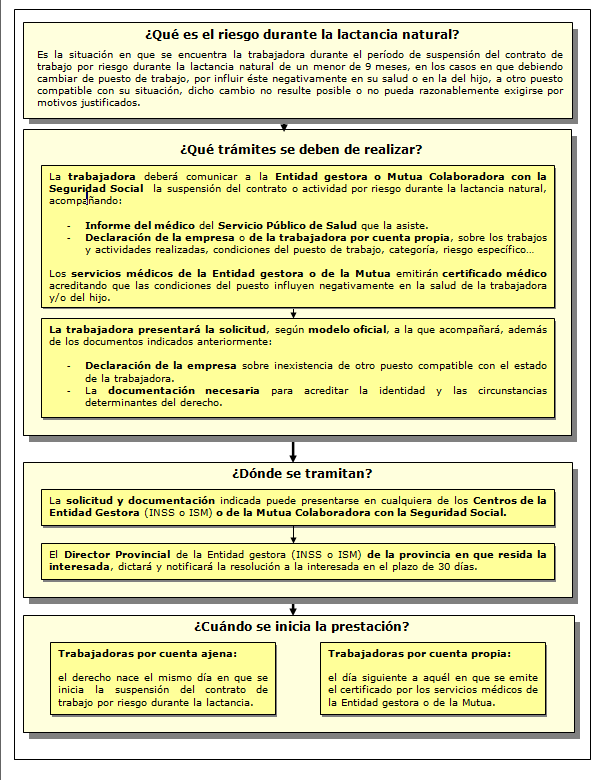
Se considera situación protegida el período de suspensión del contrato de trabajo en los supuestos en que, debiendo la mujer trabajadora cambiar de puesto de trabajo por otro compatible con su situación, en los términos previstos de la Ley 31/1995, de 8 de noviembre, de prevención de riesgos laborales, dicho cambio de puesto no resulte técnica u objetivamente posible, o no pueda razonablemente exigirse por motivos justificados.
¿Dónde tramitarlo? La solicitud y documentación necesaria deberá presentarse en cualquiera de los Centros de Atención e Información de la Seguridad Social de la Entidad Gestora o, en su caso, a la Mutua Colaboradora con la Seguridad Social.
¿Cuantía? Subsidio equivalente al 100% de la base reguladora correspondiente, que será la establecida para la prestación de IT derivada de contingencias profesionales.
El modelo de solicitud se puede descargar de la página de la Seguridad Social.
Más información: http://www.seg-social.es/Internet_1/Masinformacion/TramitesyGestiones/PrestaciondeRiesgod51461/index.htm
-
- Seguridad Social: http://www.seg-social.es
- Asociación de Mutuas de Accidentes de Trabajo y Accidentes de Trabajo: http://www.amat.es
- Real Decreto Legislativo 8/2015, de 30 de octubre, por el que se aprueba el texto refundido de la Ley General de la Seguridad Social: http://www.seg-social.es/Internet_1/Normativa/095093
-
- Que la mujer haya sido informada tres días previos a la intervención sobre derechos, prestaciones y ayudas públicas de apoyo a la maternidad.
- Que se practique por un médico especialista o bajo su dirección
- Que se lleve a cabo en un centro sanitario público o privado acreditado
- Que se realice con el consentimiento expreso y por escrito de la mujer embarazada, o en su caso, de su representante legal.
- En caso de mujeres de 16 y 17 años el consentimiento les corresponde exclusivamente a ellas. Al menos a un representante legal deberá ser informado, excepto cuando la mujer alegue que ocasionará conflicto grave o se encuentre en situación de desarraigo o desamparo.
-
El embarazo podrá interrumpirse dentro de las primeras catorce semanas de gestación.
Este plazo se puede ampliar excepcionalmente en el caso de que existan causas médicas como riesgo para la salud o vida de la embarazada, riesgo o detección de graves anomalías en el feto o enfermedad grave e incurable en el feto.
-
La mujer interesada podrá recibir voluntariamente asesoramiento antes y después de la interrupción del embarazo en los centros de atención primaria de salud del Servicio Extremeño de Salud (incluidos los Centros de Orientación Familiar y las Unidades de Salud Mental), en los centros del Instituto de la Mujer de Extremadura y en aquellas Organizaciones no Gubernamentales con actividades de atención específica sobre la IVE.
Instituto de la Mujer de Extremadura
Tlfs.: 924 93 05 12 / 14 / 924 00 74 03
e-mail: imex@juntaextremadura.net
Casa de la Mujer de Badajoz
Tlf.: 924 00 19 24 / 25 / 26
e-mail: casamujerba@juntaextremadura.netCasa de la Mujer de Cáceres
Tlf.: 927 01 08 68
e-mail: casamujercc@juntaextremadura.netAsesoría y orientación jurídica para mujeres: Fundación Anás
Tlf.: 924 30 45 95 / 654 920 800
-
- Derechos, ayudas, beneficios y prestaciones al embarazo, parto, postparto, nacimiento y cuidado y atención de los hijos. Recursos: POLÍTICAS ACTIVAS DE APOYO A LA MUJER EMBARAZADA Y A LA MATERNIDAD
- Ayudas, beneficios y prestaciones públicas de apoyo a la autonomía de las personas con discapacidad. Recursos: POLÍTICAS ACTIVAS DE APOYO A LA DISCAPACIDAD
Para ampliar información puedes consultar la Ley Orgánica 2/2010, de 3 de marzo, de salud sexual y reproductiva y de la interrupción voluntaria del embarazo
-
La vacuna frente a la Gripe estacional consiste en la administración de 3 antígenos diferentes correspondientes a 3 cepas distintas del virus de la Gripe. Estos antígenos puedes ser virus enteros inactivados o diferentes tipos de sub-unidades, es decir: partículas de la cubierta proteica del virus.
-
El virus de la Gripe presenta una gran variabilidad antigénica lo que hace que esté en continuo cambio, en cuanto a la estructura de su cubierta proteica, provocando la continua aparición de nuevas cepas virales. Esa variabilidad hace que los anticuerpos (defensas) desarrollados frente a una cepa de virus gripal no sean efectivos frente a otra cepa diferente. Dado que las diferentes cepas virales que circulan cada año cambian de una a otra temporada; eso obliga a cambiar la composición de la vacuna cada año.
-
La elaboración de la vacuna de la Gripe se basa en una predicción. En cierto sentido se parece al pronóstico del tiempo pues, al igual que los meteorólogos tienen una serie de datos sobre la atmósfera y gracias a ellos realizan una predicción sobre el tiempo que va a hacer al día siguiente, los epidemiólogos de La Organización Mundial de la Salud (OMS) realizan una función similar. La OMS recibe información de laboratorios de todo el mundo que forman parte de una red de vigilancia de la Gripe; estos laboratorios envían información sobre las cepas que aíslan a los Centros Colaboradores de la OMS. De esta forma la OMS tiene información de las nuevas cepas del virus que circulan por el mundo. Dado que la Tierra está dividida en dos hemisferios en los que se alternan las temporadas invernales (cuando en el hemisferio norte es invierno, en el sur es verano y viceversa) la OMS realiza una predicción sobre cuales van a ser las cepas que circularán durante el invierno de un hemisferio basándose en las que han circulado durante el invierno del otro hemisferio. Para el hemisferio norte, entre los meses de enero a marzo se realiza la predicción de las tres cepas que van a ser las dominantes. Generalmente esas predicciones suelen acertar, pero a veces fallan. Una vez determinadas las tres cepas con las que se ha de elaborar la vacuna, la OMS facilita muestras de estas cepas a las compañías que las van a elaborar.
-
La formulación de la vacuna frente a la Gripe para la temporada 2010-2011 en el hemisferio norte ha sido emitida por la OMS y aprobada por un grupo de expertos de la Unión Europea (UE), que ha considerado como adecuada, de acuerdo con la situación epidemiológica europea, una vacuna trivalente que incluye dos cepas de la gripe A (H1N1 y H3N2) y una de la gripe B (B Brisbane); concretamente una vacuna que contenga cepas similares a las siguientes:
- A/ California/7/2009 (nH1N1)
- A/Perth/16/2009 (H3N2)
- B/Brisbane/60/2008
-
La llamada "cepa pandémica", A/California/7/2009 (nH1N1), ha pasado a considerase una estacional, una vez que la OMS declaró el fin de la pandemia de Gripe el pasado día 10 de agosto de 2010. Esta cepa ha sido la mayoritariamente circulante durante la pasada temporada en España y prácticamente la única que circuló en Extremadura.
-
No. Cada año sólo pueden utilizarse las vacunas recomendadas para esa temporada. En este sentido, la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) ha establecido que a partir del 1 de septiembre de este año 2010, no se podrán dispensar vacunas antigripales estacionales con distinta composición de la recomendada por la OMS, prohibición que incluye a las vacunas antigripales pandémicas monovalentes utilizadas el pasado invierno para combatir la gripe A.
-
Los virus gripales circulan entre la población durante todo el año pero su circulación aumenta en la temporada de otoño-invierno debido a que las condiciones climatológicas facilitan la misma, haciendo que sea más fácil el contagio entre personas y, por tanto, el riesgo de padecer la enfermedad. En el hemisferio norte, el mayor riesgo de padecer Gripe se da a partir del mes de noviembre, por ello es necesario estar vacunado al menos 2 semanas antes de que se inicie una nueva temporada gripal, tiempo necesario para desarrollar los anticuerpos.
-
La fabricación anual de las vacunas frente a la Gripe difiere de la fabricación del resto de vacunas en que hay que hacerla con mucha mayor rapidez. Una vacuna normal puede tener un periodo de desarrollo, fabricación, estudios de eficacia y seguridad y trámites administrativos para su aprobación por las agencias reguladoras que dure varios años, manteniéndose la composición y características de la misma a lo largo del tiempo; sin embargo la composición de la vacuna de la Gripe cambia cada año, lo que hace que en realidad cada año ha de fabricarse una nueva vacuna frente a la Gripe, la cual, además, ha de estar disponible para su administración en pocos meses desde que la OMS indica cual es la composición para ese año. Una vez que la OMS decide cuales son las cepas de virus gripales que han de integrar la nueva vacuna, pone una muestra de estas cepas a disposición de los laboratorios fabricantes. Esto ocurre habitualmente en el mes de marzo de cada año. A partir de ese momento la industria farmacéutica inicia los trámites de fabricación y autorización que se resumen en la imagen siguiente. A esos trámites ha de añadirse la logística de distribución de las dosis de vacuna hasta los puntos de venta y/o administración.
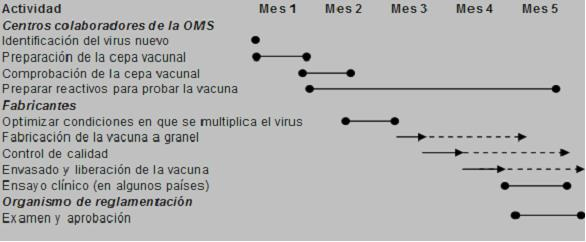
El proceso de fabricación lleva alrededor de cinco meses: los centros colaboradores de la OMS, una vez identificado el nuevo virus, durante el primer y segundo mes, realizan la preparación y comprobación de la cepa vacunal, respectivamente, para así tener preparados los reactivos antes de finalizar el quinto mes. Por otra parte, los fabricantes, después de optimizar las condiciones en que se multiplica el virus (entre el segundo y tercer mes), se dedican a la fabricación de la vacuna a granel, controles de calidad y envasado y liberación de la vacuna (todo ello a partir del tercer mes, procesos que se pueden prolongar en el tiempo), con lo cual, durante el quinto mes se realizan los ensayos clínicos que algunos países consideran. Durante este quinto mes se realizará el examen y aprobación de la vacuna, por regla general.
-
Para la fabricación de las vacunas frente a la Gripe, como para cualquier otra vacuna frente a virus, es necesario cultivar los virus a fin de obtener las cantidades suficientes de material viral, y por tanto de antígenos necesarias para los millones de dosis que se fabrican anualmente. Para ello se infecta un célula con el virus correspondiente y se espera a que se multiplique dentro de la célula, una vez multiplicado se extrae de la célula, se purifica y es desactivado u obtenido el material antigénico que es el que se incluye en la vacuna. Las células utilizadas clásicamente para cultivar los virus son huevos de gallina, ya que son relativamente fáciles de manejar y de conseguir. Actualmente existe la posibilidad de utilizar para el cultivo otro tipo de células, concretamente de riñón de mamífero, que a su vez son cultivadas en laboratorios en los llamados "reactores de cultivo"; el uso de estas células abarata y acelera el proceso de producción, pudiendo llegar a fabricarse la vacuna en semanas. Sea cual sea la técnica empleada, cada año hay que realizar nuevos cultivos con las nuevas cepas previstas porla OMS.
-
Sea cual sea la técnica de fabricación y las cepas incluidas en cada temporada, para su autorización para uso humano los fabricantes han de demostrar que la vacuna de la Gripe presenta alguno de estos criterios de protección en los grupos de edad correspondientes:
Criterio Grupo de 18 a 50 años Grupo de más de 60 años Tasa de sero-protecciónMayor del 70%
Mayor del 60%
Tasa de sero-conversiónMayor del 40%
Mayor del 30%
Factor de sero-conversiónMayor de 2.5
Mayor de 2
-
La efectividad de la vacuna frente a la Gripe depende fundamentalmente de la concordancia entre las cepas que se supone van a circular esa temporada y las que realmente circulan finalmente, ya que es habitual que aparezcan cepas nuevas no esperadas. En la tabla siguiente se observa la discordancia habida en algunas temporadas.

Las estimaciones realizadas en Extremadura en las temporadas 2003-2004 y 2004-2005 basada en los datos facilitados por los médicos de atención primaria participantes en el Sistema Centinela de la Gripe muestra una Efectividad directa(*) para la temporada 03/04 del 72,96% (I.C. 95% 64,1-79,6) y para la temporada 04/05 del 30,00% (I.C. 95% 17'9-40'3).
(*) Nota: Efectividad directa = protección conferida en los vacunados. Su interpretación es que una persona vacunada frente a Gripe en 2003 presentaba una protección (una probabilidad de no enfermar de Gripe) del 73 % en comparación con una no vacunada.
Desde el punto de vista de la Salud Pública no sólo interesa la protección individual que confiere la vacuna frente a la Gripe, sino que tanto o más interesante es la protección colectiva que se pueda conseguir gracias al efecto de la "inmunidad colectiva" o "inmunidad de rebaño" que otorga la vacuna frente a Gripe dada las características epidemiológicas de esta enfermedad (la fuente de infección es la persona enferma y el mecanismo de transmisión es persona-persona).En este sentido las estimaciones realizadas por el Sistema Centinela de la Gripe muestra una Efectividad poblacional(**) para la temporada 2003/2004 del 58,98% (I.C. 95%: 55,4 - 62,2), y para la temporada 2004/2005 del 45'53% (I.C. 95%: 42'02 - 48'8), con una media por temporada del 52% .
(**) Nota: Efectividad poblacional = protección conferida en TODA la población, vacunados y no vacunados, gracias a inmunidad de los vacunados. Su interpretación es que durante la temporada 2003/2004 se presentaron un 59 % menos de casos de Gripe que los que se hubieran presentado en una temporada normal sin programa de vacunación (la vacunación evitó el 59 % de los casos esperados en toda la población).
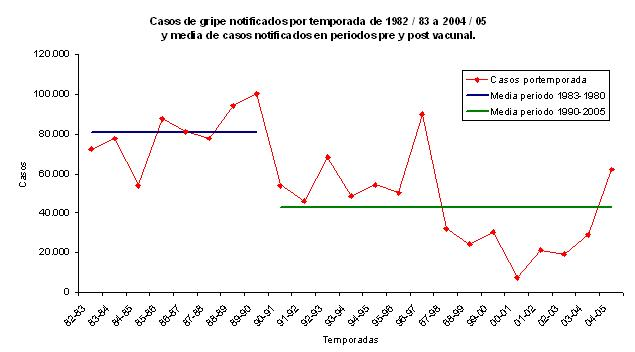
Esos datos son consistentes con los obtenidos de la monitorización de la Gripe a través del Sistema de Enfermedades de Declaración Obligatoria (EDO) que refleja que en las temporadas anteriores al establecimiento de los programas de vacunación masiva frente a la Gripe, la media de casos de Gripe era de alrededor de 80.000 casos por temporada, mientras que después de la puesta en marcha de esos programas la media de casos de Gripe es de alrededor de 40.000 casos por temporada, como se muestra en el siguiente gráfico.
Temporada
Casos (rango de valores)
82-83 70.000 - 80.000 83-84 70.000 - 80.000 84-85 50.000 - 60.000 85-86 80.000 - 90.000 86-87 80.000 - 90.000 87-88 70.000 - 80.000 88-89 90.000 - 100.000 89-90 100.000 - 110.000 90-91 50.000 - 60.000 91-92 40.000 - 50.000 92-93 60.000 - 70.000 93-94 40.000 - 50.000 94-95 50.000 - 60.000 95-96 40.000 - 50.000 96-97 80.000 - 90.000 97-98 20.000 - 30.000 98-99 20.000 - 30.000 99-00 20.000 - 30.000 00-01 0 - 10.000 01-02 10.000 - 20.000 02-03 10.000 - 20.000 03-04 20.000 - 30.000 04-05 60.000 - 70.000 "La media para el periodo 1983-1990 se encuentra en torno a los 80.000 casos mientras que la media para el periodo 1990-2005 se encuentra en torno a los 40.000 casos."
Podemos concluir que en Extremadura se evitan alrededor de 40.000 casos clínicos de Gripe cada temporada gracias al programa de vacunación, además de un cierto número de complicaciones, ingresos e incluso muertes.
-
La vacunación frente a la Gripe es una de las medidas más costo/efectivas, a pesar de que la efectividad individual o directa pueda ser baja, dada la elevada incidencia de la enfermedad y la ya comentada capacidad para inducir inmunidad colectiva que presenta esta vacuna. Asumiendo que en Extremadura con el programa de vacunación podemos evitar alrededor de 40.000 casos de los teóricos 80.000 que esperaríamos esta temporada si no vacunáramos, y teniendo en cuenta que el coste de las 270.000 dosis compradas por el SES ha sido de 1.575.000 euros, resulta que evitar cada un caso de gripe costará a las arcas públicas 39,9 euros. Por el contrario tratar un caso de Gripe puede suponer entre 80 y 120 euros según estimaciones del Sistema Centinela de Gripe, por lo que tratar los 40.000 casos presumiblemente evitables costaría al erario público entre 3.200.000 y 4.800.000 euros.
-
A pesar de la rapidez en su fabricación, las agencias reguladoras exigen unos estudios mínimos sobre la seguridad de la vacuna año tras año. La vacuna frente a la Gripe puede presentar efectos secundarios similares a los de cualquier otra vacuna, normalmente leves y pasajeros, no obstante siempre ha de tenerse en cuenta lo indicado en la ficha técnica de la vacuna concreta de cada temporada. A favor de la seguridad de la vacuna frente a la Gripe estacional habla el hecho de que en Extremadura se han notificado al Sistema Español de Farmacovigilancia a través del Centro Regional de Farmacovigilancia, un total de cuatro sospechas de reacciones adversas a vacuna de Gripe estacional desde enero de 2005 hasta septiembre de 2010. La mayor contraindicación y por tanto posible riesgo de reacción adversa, es la de la administración en personas alérgicas al huevo de vacunas de Gripe cultivadas en estos, por la posibilidad de contener algún resto de proteínas de huevo a pesar de la purificación a la que se les somete.
-
NO. Las vacunas pueden contener virus enteros "inactivados" o partículas antigénicas de la capsula del virus; en ambos casos SIN capacidad para reproducirse ni, por lo tanto, para producir enfermedad.
-
La vacunación frente a la Gripe es recomendable para cualquier persona mayor de 6 meses de edad, salvo que exista alguna contraindicación personal (por ejemplo; la alergia al huevo). Los programas de vacunación establecidos por las Autoridades de Salud Pública basan sus recomendaciones hacia ciertos grupos de población en función de varios criterios:
- Criterio de "mayor riesgo de gravedad": En primer lugar la vacuna se recomienda a aquellas personas que en caso de enfermar por Gripe tienen un mayor riesgo de sufrir complicaciones o de presentar cuadros de gravedad, y que en general son las mayores de 60 años de edad y las que presentan ciertas enfermedades crónicas o circunstancias especiales.
- Criterio de "corte de la cadena de transmisión": En segundo lugar la vacuna se recomienda para todas las personas que por su trabajo u otra circunstancia están o pueden estar en contacto directo y estrecho con las personas indicadas en el párrafo anterior, y a las cuales podría transmitir la enfermedad. Aquí se incluye, por ejemplo, el personal sanitario que atiende a enfermos crónicos o los familiares de dichos enfermos.
- Criterio de "indicación social": En último lugar la vacuna se recomienda para todas las personas cuyo trabajo se considera esencial para la sociedad y, que en el caso de enfermar de Gripe, la ausencia masiva a sus puestos de trabajo pueda suponer un problema social; como sería el caso de policías, bomberos o docentes.
-
Según lo dicho anteriormente y en consonancia con las recomendaciones del Comité Consultivo para la Práctica de las Inmunizaciones de la Organización Mundial de la Salud (OMS), se consideran como grupos prioritarios objeto de la vacunación y, por tanto, constituyen la población diana de la Campaña de Vacunación Antigripal 2010-2011 los siguientes:
- Todas las personas a partir de 60 años de edad cumplidos.
- Personas menores de 60 años, que por presentar una condición clínica especial tienen un alto riesgo de complicaciones derivadas de la gripe o en las que el padecer la enfermedad pueda provocar una descompensación de su condición médica: Niños/as (mayores de 6 meses) y adultos con enfermedades crónicas cardiovasculares o pulmonares.
- Niños/as (mayores de 6 meses) y adultos con enfermedades metabólicas crónicas.
- Personas que conviven en residencias, instituciones o en centros que presentan asistencia a enfermos crónicos de cualquier edad.
- Niños/as y adolescentes, de 6 meses a 18 años, que reciben tratamiento prolongado con ácido acetil salicílico.
- Mujeres embarazadas.
- Personas que pueden transmitir la gripe a aquellas que tienen un alto riesgo de presentar complicaciones:
- Trabajadores de los centros sanitarios.
- Personas que, por su ocupación, trabajan en instituciones geriátricas o centros de atención a enfermos crónicos.
- Personas que proporcionen cuidados domiciliarios a pacientes de alto riesgo de sufrir complicaciones o ancianos.
- Personas que conviven en el hogar, incluidos niños/as, con otras que pertenecen a algunos de los grupos de alto riesgo de complicaciones por su condición clínica especial (citados en el punto 2).
- Otros grupos en los que se recomienda la vacunación:
- Personas que, por su ocupación, prestan servicios comunitarios esenciales.
- Viajeros internacionales en determinadas circunstancias.
-
El Servicio Extremeño de Salud para la campaña 2010-2011 ha adquirido un total de 270.000 dosis de vacuna, lo que ha supuesto un coste de 1.575.600.
-
En Extremadura, como en el resto de España, el periodo de tiempo recomendado es a lo largo del mes de octubre y noviembre, para así tener el mayor número de defensas cuando se presenta el mayor riesgo de infección, a partir del mes de noviembre. Este año, 2010, la campaña de vacunación frente a la Gripe comienza el lunes día 4 de octubre, y finaliza el día 30 de noviembre.
-
Suelen aparecer aproximadamente a los 15 días de la administración, por ello es importante vacunarse antes de que llegue el periodo de mayor riesgo de infección, a partir de noviembre.
-
Las dosis a administrar son las habituales en las vacunas estacionales:
- Adultos y niños a partir de 36 meses de edad: una dosis de 0,5 ml. En los niños entre 36 meses y 9 años que no se hayan vacunado con anterioridad, en años anteriores, se administrará una segunda dosis transcurridas 4 semanas de la primera.
- Niños de 6 meses a 35 meses: una dosis de 0,25 ml. En estos niños que no se hayan vacunado con anterioridad, en años anteriores, se administrará una segunda dosis transcurridas 4 semanas de la primera.
-
De forma general, las contraindicaciones absolutas son:
- NO administrar las vacunas de gripe a lactantes menores de 6 meses.
- NO administrar a personas alérgicas al huevo
De forma específica, las vacunas adquiridas esta temporada 2010-2011 presentan las siguientes contraindicaciones y precauciones según su ficha técnica.
En el caso de CHIROMAS ®:
- Hipersensibilidad a los principios activos, a cualquiera de los excipientes, a los huevos, proteínas del pollo, sulfato de neomicina y kanamicina, formaldehído, y bromuro de cetiltrimetilamonio (CTAB).
- La inmunización deberá posponerse en los pacientes con enfermedad febril o infección.
En el caso de GRIPAVAC ®:
- Hipersensibilidad a los principios activos, a cualquiera de los excipientes y a los residuos, por ejemplo: huevos, a la ovoalbúmina, proteínas de pollo.
- La vacuna puede contener otros residuos de las siguientes sustancias: neomicina, formaldehído y octoxinol 9.
- La inmunización se retrasará en pacientes con enfermedad febril o infección aguda.
-
En caso de cambio de domicilio, deberá comunicarlo a la Unidad de Tarjeta Sanitaria de su Centro de Salud. Recuerde que sólo así podrá recibir en su casa las citas de Atención Especializada, o la tarjeta sanitaria en caso de pérdida o deterioro.
-
Debe acudir al Centro de Salud que le corresponda con su DNI/NIE y Tarjeta Sanitaria.
-
La tarjeta se solicita en la Unidad Administrativa del Centro de Salud que corresponda por domicilio.
-
Cuando se solicita un alta en nuestro sistema sanitario por primera vez debe dirigirse al Centro de Salud que le corresponde por zona y aportar la siguiente documentación:
-DNI/NIE/Tarjeta de residente comunitario, pasaporte, permiso de conducir o cualquier otro documento que acredite fehacientemente su identidad.
-
La Tarjeta Sanitaria ya NO CADUCA (independientemente de que venga impresa una fecha de caducidad en la misma).
-
La Tarjeta Sanitaria emitida por la Consejería de Sanidad y Políticas Sociales de la Junta de Extremadura, es válida en todo el Sistema Nacional de Salud (SNS), y permitirá identificarse en cualquier otra Comunidad Autónoma. Por tanto, no es necesario cambiar de tarjeta cuando nos movemos por el Territorio del Sistema Nacional de Salud, sino darse de alta como desplazado en la Comunidad Autónoma de destino, siempre y cuando esos desplazamientos sean temporales y no supongan un cambio definitivo de residencia.
-
No. La Tarjeta Sanitaria Europea es una tarjeta cuya tramitación y expedición es competencia del Instituto Nacional de la Seguridad Social INSS, por lo tanto deberá solicitarse en el Centro de Atención e Información de la Seguridad Social CAISS.
-
Solicitándolo en el centro de salud donde esté adscrito.
-

Los datos que contiene el chip: código de identificación personal autonómico (CIP), código de identificación personal en el SNS, código de la entidad emisora de la tarjeta (CITE), nombre y apellidos. Como datos regrabables en el chip están: la fecha de nacimiento, el sexo y el número de tarjeta emitida. Los datos que aparecen en la banda magnética son: código de identificación personal autonómico (CIP), código de identificación personal en el SNS y nombre y apellidos.
-
La prescripción y dispensación electrónica de un medicamento prescrito en receta electrónica por un profesional sanitario del Servicio Extremeño de Salud podrá ser dispensada en cualquier farmacia de otro país de la Unión Europea que ya esté funcionando con este sistema.
Puede usar el siguiente enlace para ver qué países europeos pueden actualmente intercambiar prescripciones electrónicas:
https://www.sanidad.gob.es/areas/saludDigital/recetaElectronicaUE/mapaRecetaUE.htm

-
Si usted va a viajar a otro país de la Unión Europea y necesita recoger medicación en una oficina de farmacia de allí, inicialmente le mostrarán un documento de información escrito en español (este es un ejemplo de dicho documento:
https://www.sanidad.gob.es/areas/saludDigital/recetaElectronicaUE/docs/ep-pin-es.pdf), donde se recoge como van a ser tratados sus datos personales en el país donde va a recoger su medicación. Una vez leído el documento, y si está de acuerdo con el contenido, lo manifestará de forma verbal. En ese momento, el farmacéutico ya podrá acceder a sus datos de identificación y a su medicación dispensable, para lo cual deberá mostrar su tarjeta sanitaria del Servicio Extremeño de Salud junto con su DNI o Pasaporte. Es importante conocer que la tarjeta sanitaria europea NO es válida para recoger la medicación.Los datos que el farmacéutico deberá verificar de su tarjeta sanitaria dependerán del tipo de tarjeta sanitaria que disponga. Para los casos en los que su tarjeta incorpore el “Código SNS” (“National Person Identifier” para los farmacéuticos europeos), sólo será necesario este dato para buscar sus recetas. Este identificador se caracteriza porque siempre empieza por 8 Bs:



Para los casos en los que su tarjeta sanitaria no incorpore el “Código SNS” se deberá proporcionar el CIP (“Regional Person Identifier” para los farmacéuticos europeos), que es un código de 4 caracteres alfabéticos seguido de 12 caracteres numéricos y el CITE (“Region Identifier”), que para Extremadura es siempre el valor 803413:

-
Si usted visita España y necesita recoger en una oficina de farmacia extremeña la medicación prescrita en su país de origen, antes de acceder a sus datos en la farmacia le mostrarán un documento para informarle sobre el tratamiento de sus datos personales en España. Esta información estará escrita en la lengua oficial de su país de origen.
Si usted estuviera de acuerdo con dicho tratamiento de datos, lo indicará al farmacéutico y en ese momento este ya podrá acceder a sus datos de identificación y a su medicación dispensable.
-
A través del siguiente enlace podrá ver una serie de preguntas frecuentes sobre la interoperabilidad de la receta electrónica europea:
https://www.sanidad.gob.es/areas/saludDigital/recetaElectronicaUE/faq/faq.htm